どーも、ききです。
今回は危険物甲種試験の「物理・化学」について解説していきます。
難易度は高く、この「物理・化学」が一番の鬼門に感じる人も多いでしょう。
甲種での出題レベルは高校レベルの物理、化学、数学の知識が最低限必要なので、学生時代から長らく勉強をしていない人にとっては、また1から勉強しなくてはいけません。
純粋に参考書では細かい部分まで解説していない場合があるので、しっかり理解するためには高校生の教科書が必要な場合もあります。
と言っても、基礎的な問題が多いので計算問題の応用などの知識は問われません。
こちらの記事では出来るだけ分かりやすく解説していきますので、もし分からない点などあればコメントなどでお知らせ下さい。
ただ、自分も物理・化学のスペシャリストではないのでご了承ください。分かる範囲で解説していきます。
では早速初めていきます。
燃焼の化学
- 燃焼の3要素は①可燃性物質②酸素供給体③点火源。どれか一つでも欠けると燃焼は起こらない
- 酸化反応でも、吸熱反応を示すものは燃焼とは言わない
燃えやすい要素として
- 空気との接触面積が大きいもの
- 熱伝導率が小さいもの
- 活性化エネルギーが小さいもの
特に熱伝導と活性化エネルギーは良く出題されます。
また、火炎を有しない無炎燃焼は固体特有の燃焼形態です。
燃焼の区分
可燃性ガスは、空気とある濃度範囲で混合しないと燃焼しない。この燃焼可能な濃度範囲を燃焼範囲と言います。
ガソリンやアルコールなどの可燃性液体は、それ自身が燃えるのではなく、液体の蒸発によって生じた蒸気が着火して火炎を生じ、燃焼します。この事を蒸発燃焼。
固体の燃焼は
- 表面燃焼…固体のまま空気と接触している表面が直接燃焼する(木炭、コークス、金属粉)
- 蒸発燃焼…液体の蒸発燃焼と同じで蒸発した蒸気が燃焼する(硫黄、ナフタレン)
- 分解燃焼…可燃性固体が加熱されて熱分解を起こし、可燃性ガスを発生させそれが燃焼する(木材、石炭、紙、プラスチック)
- 自己燃焼…分解燃焼のうち、可燃性固体が内部に有している酸素によって燃焼する(ニトロセルロース、第5類危険物が該当)
化学反応式
ここから急に化学っぽくなってきます(悪夢

まず1molには6.02×1023の原子が含まれており、1molの質量を求める場合、純粋に原子量を足したものになります。
例として
二酸化炭素(CO2)の1molの質量は
C=12、O=16なので、12+16+16=44
となるので質量は44gとなります。
ちなみに、気体の体積は全て1molあたり22.4ℓとなります(アボガドロの法則)
質量と体積で異なる数値になるのでちょっと迷いますが、しっかり覚えておきましょう。
っとここまでは乙類レベルの話なのでこの辺にします。
甲種では主に完全燃焼した時の必要酸素量や空気量を求めます。
この酸素量を求める公式ですが
〇〇(化学式or示性式)+〇〇O₂→〇〇CO₂+〇〇H₂O
この公式を覚えておけば、全ての物質の必要酸素量を求める事が出来ます。
分子式は元素記号を組み合わせて物質の構造を示す式ですが、分子式の場合、同じ分子量で異なる性質を持つ物質の判別が難しくなります。その為、示性式と呼ばれる構造式を簡単にして官能基を示した化学式があります。
例えばエタノールとジメチルエーテルは分子式は共に同じC2H6Oとなりますが、全く性質が異なります。
この場合、この2つを示性式で表すと
- エタノール…示性式C₂H₅OH
- ジメチルエーテル…示性式CH₃OCH₃
となり、どのような構造を持っているか分かりやすくなります。
基本的に甲種の試験では示性式で表す事が多いです。
酸素量を求めるだけ場合は分子式でも問題ないんですが、問題文で示性式が示されていない場合、ある程度の示性式を暗記しておく必要があります。
例題として3問紹介します。共に出題率が高い問題なので、しっかり押さえておきましょう。
・アセトン(CH₃COCH₃)11.6gが完全燃焼する時に必要な空気の標準状態(0℃、1気圧)における体積として、次のうち最も近いとのはどれか。なお、空気中の酸素は体積の割合で20%を占めるものとし、原子量はH=1、C=12、O=16とする。
①18ℓ、②20ℓ、③45ℓ、④90ℓ、⑤101ℓ
この問題は問題文に示性式が表記されているので、そのまま先程の酸素量を求める公式に当てはめます。
〇〇CH₃COCH₃+〇〇O₂→〇〇CO₂+〇〇H₂O
ここで、右辺と左辺のそれぞれの元素の数を合わせます。
まず、両辺のCの数に着目すると、左辺が3つで右辺が1つです。
なので、左辺のCH₃COCH₃の係数は1で右辺のCO₂の係数は3となり、3CO₂となります。
この状態で次は両辺のHの数を見てみると、CH₃COCH₃の係数は1なのでHの数は6つとなります。
右辺のH₂OはHが2つなので、3倍すると左辺の6つと同じになります。したがってH₂Oの係数は3つなので3H₂Oとなります。
ここまでまとめると
CH₃COCH₃+〇〇O₂→3CO₂+3H₂O
このようになるので、あとはOの係数を数えていきます。
まず、右辺の3CO₂は3×2で6つ、3H₂Oは3×1で3つとなるので、右辺の合計は9つとなります。
左辺のCH₃COCH₃はOが1つなので、足りないOの数は8つとなり、O₂の係数は4×2で8になるので、4O₂となります。
したがって、全ての係数をまとめると
CH₃COCH₃+4O₂→3CO₂+3H₂Oとなります。
つまり、アセトン1molを燃焼させるのに必要な酸素量は4molと分かります。
アセトンは11.6gとあります。アセトン1molあたりの質量はCH₃COCH₃でH=1、C=12、O=16とあるので、
6×1+3×12+16=58g
となり、そのうち11.6gは
11.6÷58=0.2となります。
なので、11.6gは0.2molということが分かりました。
そこで、先程の酸素量を求めた式と参照すると、1molで4倍の4molの酸素が必要だったので、0.2molはその4倍の0.8molとなります。
この0.8molの体積は1molあたり22.4ℓなので、
22.4×0.8=17.92となります。
ここで、選択肢の①かなって思いますが、それは罠です。

問題文では空気の体積を求めるように問われています。
空気中の酸素は体積の割合で20%を占めるものとされているので、純粋に先程求めた酸素の体積を5倍すれば空気の体積を求める事が出来ます。
17.92×5=89.6
この数値が1番近いのは④の90ℓとなります。
慣れないうちは時間が掛かる計算ですが、慣れるとすんなり解けるようになります(次の問題で解きやすくなる公式も解説します)
ぶっちゃけもっと難しい問題が今後まだ出てくるので、ここで挫けないようにして下さいね(無理

次の問題が
・次の有機化合物1molを空気中で完全燃焼させる時、必要な酸素の量が最も少ないのはどれか。
①エタノール、②ジエチルエーテル、③酢酸、④アセトアルデヒド、⑤メタノール
この問題は先程と同じ酸素量を求める解き方で求める事が可能ですが、こちらは化学式が明記されていません。
その為、ある程度暗記しなくてはいけないのですが、正直この問題で出題されている物質達は良く出題されるので暗記しなくてはいけません。
しかし、丸暗記するのではなく、それぞれの官能基を理解すれば比較的覚えやすいと思います。
官能基を含めた有機化合物の基礎については次の項目で解説します。
問題に戻りますが、この問題の化合物の示性式は
- エタノール…C₂H₅OH
- ジエチルエーテル…C₂H₅OC₂H₅
- 酢酸…CH₃COOH
- アセトアルデヒド…CH₃CHO
- メタノール…CH₃OH
ここで、例の酸素量を求める公式に当てはめて求めますが、量が多いので全て反応式を書いて求めると時間が掛かります。
その為、ここでとあるテキストに載っていた最強の求め方を解説します。
(2C+0.5H−O)÷2=必要酸素量
最初の問題のアセトン(CH₃COCH₃)の酸素量をこの公式で求めてみましょう。必要酸素量は4でしたが
(2×3+0.5×6−1)÷2=4
同じ値になりました。
この公式を覚えておけば、いちいち反応式を書かなくても解けるようになります。慣れてくると頭の中で計算も可能となります。
これを踏まえて今回の問題を解いて見ると
- エタノール…C₂H₅OH=(2×2+0.5×6−1)÷2=3
- ジエチルエーテル…C₂H₅OC₂H₅=(2×4+0.5×10−1)÷2=6
- 酢酸…CH₃COOH=(2×2+0.5×4−2)÷2=2
- アセトアルデヒド…CH₃CHO=(2×2+0.5×4−1)÷2=2.5
- メタノール…CH₃OH=(2×1+0.5×4−1)÷2=1.5
となります。この中で1番酸素量が少ないのは⑤のメタノールと分かりました。
反応式と今回の公式両方覚えるのがベストですが、最悪今回の公式だけ覚えておけば解けるので是非覚えて下さい(示性式は別に覚える必要があります)
次の問題が
・過塩素酸201kgから過塩素酸ナトリウム245ktmgを生成するのに必要な炭酸ナトリウムの量として、次のうち正しいものはどれか。なお、原子量はH=1、C=12、O=16、Na=23、 Cl=35.5とする。
①53kg、②106kg、③201kg、④212kg、⑤424kg
この問題は解き方も覚える必要がありますが、そもそも過塩素酸や過塩素酸ナトリウムなどの化学式を覚えていないと歯が立ちません。
過塩素はClO4と覚えておけば、過塩素酸はHClO₄、過塩素酸ナトリウムはNaClO₄と分かります。炭酸ナトリウムはNa₂CO₃です。これはそのまま覚えましょう。
Naの数が1とか2とか良く分からなくても大丈夫。とりあえずそのまま覚えて下さい(簡単に言うな
この記事を最後まで読めば少しは理解出来ると思います(酸化還元反応で解説します)

さぁ、この化学式を覚えたら後は解き方です。
まず基本的な形は酸素量を求める公式に似ていますが
〇〇〇+〇〇〇→〇〇〇+H₂O+CO₂
このような形になります。
つまり、AとBを足してABにする時に水と二酸化炭素も生成されるという事です。
その上で先程の化学式を当てはめると
〇〇HClO₄+〇〇NaCO₃→〇〇NaClO₄+〇〇H₂O+〇〇CO₂
このようになります。
後は両辺の係数を合わせて
2HClO₄+NaCO₃→2NaClO₄+H₂O+CO₂となります。
この式から2つの過塩素酸と1つの炭酸ナトリウムを足すと2つの過塩素酸ナトリウムが生成される事が分かります(水と二酸化炭素は割愛
そして、問題文にある原子量を代入します。
- 過塩素酸…1+35.5+16×4=100.5
- 過塩素酸ナトリウム…23+35.5+16×4=122.5
- 炭酸ナトリウム…23×2+12+16×3=106
このようになります。
分かる人はもう分かってるかもしれませんが、実はもうこの中に答えはあります。ふふふ。

2molの過塩素酸と1molの炭酸ナトリウムから2molの過塩素酸ナトリウムが生成されている事から、
過塩素酸(2×100.5=201)+炭酸ナトリウム(1×106=106)→過塩素酸ナトリウム(2×122.5=245)となります。
ここで問題文を見ると、過塩素酸201kg、過塩素酸ナトリウム245kgとあるので、炭酸水素ナトリウムのこの数値が答えとなる訳です。
よって答えは②となります。
有機化合物の基礎
炭素原子を骨格とする化合物を有機化合物といい、それ以外の化合物を無機化合物という
それぞれの特徴の違いは以下の通りです。ここが出題される事もあるので一通り目を通しておいた方がいいです。
| 有機化合物 | 無機化合物 | |
| 構成元素 | 少ない | 多い |
| 化学結合 | 一般的に共有結合 | 一般的にイオン結合 |
| 燃焼性 | 可燃性のものが多い | 不燃性のものが多い |
| 沸点と融点 | 一般的に低い | 一般的に高い |
| 水溶性 | 水に溶けにくいものが多い | 水に溶けやすいものが多い |
| 有機溶媒 | 溶けやすいものが多い | 溶けにくいものが多い |
| 比重 | 水より軽いものが多い | 水より重いものが多い |
有機化合物の結合はエタン(CH₄)のような単結合、それ以外にエチレン(CH₂=CH₂)のような二重結合、アセチレン(CH≡CH)のような三重結合とあり、単結合を飽和炭化水素、二重三重結合を含むものを不飽和炭化水素といいます。
この飽和炭化水素の事をアルカンと呼びます。アルカンは直鎖式で構成され炭素数によって呼び方が変わります。
- 炭素数1…メタンCH4
- 炭素数2…エタンC2H6
- 炭素数3…プロパンC3H8
- 炭素数4…ブタンC4H10
- 炭素数5…ペンタンC5H12
- 炭素数6…ヘキサンC6H14
- 炭素数7…ペプタンC7H16
ちなみに炭素数が4以上になると異性体が存在します。アルカンの一般式はCn+H₂n+2となります。
二重結合の不飽和炭化水素をアルケンと呼び、三重結合をアルキンと呼びます。それぞれ、エチレン、アセチレンが該当し、計算式はCn+H₂n、Cn+H₂n-2となります。
エチレンはアルコールの脱水反応、アセチレンは炭化カルシウムに水を加えて作ります(別名カーバイト)
※高圧ガスの学識でも何か聞いた事が…
炭化水素基と官能基
炭化水素から水素原子一個取れたものを炭化水素基と呼び、有機化合物の性質を決める働きを持つものを官能基と呼びます。
官能基の種類と化合物についてはこちらの表を参照して下さい(かなり重要)
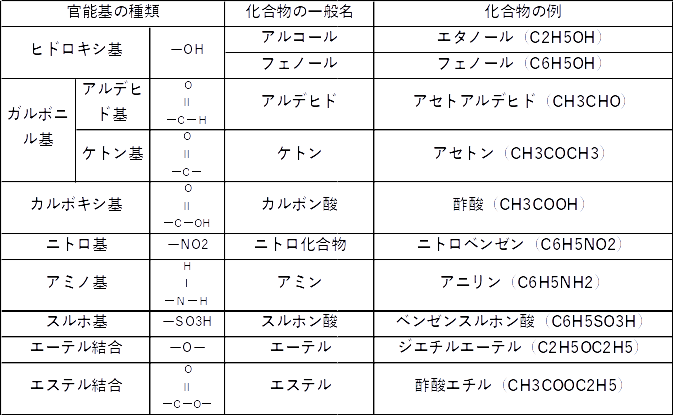
例として、酢酸を解説します。
酢酸はCH₃COOHですが、このまま暗記するのではなく、まずベースのメタンCH₄を覚えます。
このCH₄のHをカルボキシ基COOHに置き換える事でCH₃(CH₄からH一つを置き換える)+COOH=CH₃COOHとなります。
メタン、エタンが1番のベースとなるので、この2つを覚えてあとはその中のHを官能基に変換するだけである程度の示性式はカバー出来るので、是非覚えて下さい(というか絶対覚えた方がいいです
脂肪族化合物
上の項目で出てきた官能基のヒドロキシ基は一般的にアルコールと呼ばれています。
このアルコールはヒドロキシ基-OHの数によって、一価アルコール、二価アルコール、三価アルコールに分類されます。
また、ヒドロキシ基が結合している炭素原子に他の炭素原子が何個結合しているかによって、第一級アルコール、第二級アルコール、第三級アルコールに分類されます。
ちなみにヒドロキシ基は水中で電離しないので、水溶液は中性を示します。
第一級アルコールを酸化させるとアルデヒドになり、更に酸化させるとカルボン酸になります。
メタノール→ホルムアルデヒド→ギ酸
エタノール→アセトアルデヒド→酢酸
第二級アルコールを酸化するとケトンを生じます。代表的なものはアセトン(CH3COCH3)です。
このエーテルはエタノールの脱水結合によって得られ、エーテルとアルコールは構造異性体の関係になります。
カルボン酸とアルコールが縮合して生成する化合物をエステルと言います。
代表的なものとして、酢酸とエタノールの混合物に少量の濃硫酸を加えると縮合反応によって酢酸エチルと水が生成されます。
CH₃COOH+C₂H₅OH→CH₃COOC₂H₅+H₂O
芳香族化合物
ベンゼンC₆H₆のように六角形の環状に結合している炭素骨格をベンゼン環といい、このようなベンゼン環を持つ炭化水素を芳香族炭化水素といいます。
芳香族炭化水素も官能基の組み合わせで覚える事が出来ます。
トルエン(C₆H₅CH₃)はベンゼンの水素原子をメチル基-CH3で置換したものです。
キシレン((C₆H₄(CH₃)2)はベンゼンの水素原子2つをメチル基で置換したもので、メチル基の位置によってオルト、メタ、パラ3種類の構造異性体があります。
フェノールはベンゼン環に直接ヒドロキシ基が結合しているもので、同じヒドロキシ基を持つのでアルコールと共通した性質を持ちます。
このフェノールに濃硫酸と濃硝酸の混合物を加えてニトロ化するとみんな大好きピクリン酸を生成します。※意味が分からなくてもこのまま覚えておいて下さい。結構試験に出てきます。
フェノール樹脂はフェノールとホルムアルデヒドが付加反応と縮合反応を繰り返す事で得られます。
とりあえず化学反応式系はここまでにします。
あまり聞き慣れない言葉ばかりでお疲れかと思いますが、物理化学はまだまだ続きます…

燃焼範囲
- 燃焼上限値が高く、下限値が低いものほど危険性は大きい
- 温度や圧力が上昇すると燃焼範囲は広くなる傾向にある
- ガソリンの爆発範囲は1.4〜7.6vol%
ガソリンの覚え方は
リンは自分の意思でみんなが喜ぶ演出になろうとした
リン(ガソリン)は自分の意思(1.4)でみんなが喜ぶ演出になろう(7.6)とした

ありがたや~
引火性液体の性状
- 蒸気比重は空気との比率
- 液温が沸点まで加熱されるとその蒸気圧は標準大気圧と等しくなる
また、引火点<燃焼点<発火点。この並びは覚えておきましょう。
自然発火と粉塵爆発
自然発火とは点火源や加熱されていない状況でも、自然に発熱し長時間蓄積され発火する現象です。
発熱の機構ごとにまとめると
- 酸化…乾性油、石炭、鉄粉、亜鉛粉
- 分解…セルロイド、ニトロセルロース
- 発酵…干し草、干しわら
- 吸着…活性炭、木炭粉末
- 重合…エチレンがポリエチレンに重合
この中の乾性油の油脂の不飽和度合いはヨウ素価の値で判断でき、その中でアマニ油は最も大きい。
粉塵爆発はガス爆発より最小着火エネルギーが大きいので着火しにくいが、発生するエネルギーは粉塵爆発の方が数倍大きい。
消火剤と消火効果
各消火剤のまとめはこちらの表をご覧下さい。

それぞれ一つずつ覚えるのはかなりの労力を使うのでポイントだけ押さえておきます。
- 冷却作用があるのは水系と二酸化炭素、金属火災用消火器
- 抑制作用があるのは霧状の強化液、ハロゲン、粉末系消化器
- 油系の火災では水消火器、棒状の強化液は使えない
- 電気系の火災では水、強化液の棒状のものと泡消火器が使えない
油系、電気系の覚え方は
油に水を掛けたら凶暴になった
油(油系)に水(水消火器)を掛けたら凶(強化液)暴(棒状)になった
電気に泡を掛けたらボウボウ燃えた
電気(電気系)に泡(泡消火器)を掛けたらボウボウ(水と強化液の棒状)燃えた

法令の語呂合わせより覚えやすいと思います(自画自賛
静電気
- 静電気は絶縁抵抗が大きい程発生しやすい
- 異符号の電荷の間には吸引力、同符号の間には反発力が働く
- 静電気力は2つの点電荷の電気量の積に比例し距離の2乗に反比例する(クーロンの法則)
静電気のエネルギーについては2つ公式を覚えておきます。
Q=CV(帯電量Q、電圧V、静電容量C)
E=1/2QV
問題文で提示してある場合もありますが、提示してない事もあるので覚えておくとすんなり解く事が出来ます。
また、静電気を放電させるには
- アース(接地)をする
- 湿度を高める
分子間力
- イオン結合…金属と非金属の結合
- 共有結合…共に非金属結合
- 金属結合…そのまま共に金属結合
あとファンデルワークス力とか言う意味不明な名前も分子間力の所で出てきますが、分子間に働く引力と覚えておきましょう(多分出題されない
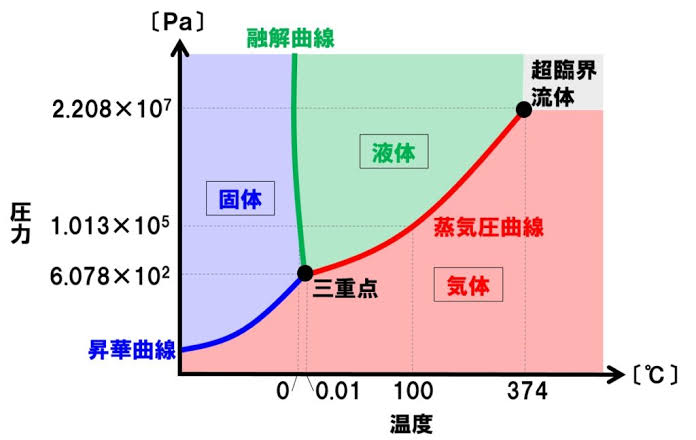
物質の三態
こちらの図が分かりやすいので、参考までに貼っておきます。
引用:大学受験対策ポイント解説サイト|TEKIBO
それぞれの曲線の名前や物質の状態の場所を押さえておきましょう。
他に覚える部分として
- 固体の溶解度は温度が高くなると大きくなる
- 気体の溶解度は温度が高くなると小さくなるが圧力が高くなると大きくなる
- 溶媒と溶液の凝固点または沸点の差を凝固点降下度または沸点上昇度という
- この2つは溶質の種類に関係なく溶液中の溶質の質量モル濃度に比例する
単体・化合物・混合物
- 単体は純物質でただ1種類の元素からなり、通常の元素名と同じ
- 化合物は分解して2種類以上の物質に分ける事ができる
- 無機化合物は有機化合物以外の化合物
- 気体の混合物は必ず「気体」+「気体」、液体は「液体」+「気体」や「固体」がある
- 一般に混合物は、蒸留や濾過などの操作により2以上の成分に分けられる
コロイド
- コロイド溶液に少量の電解質を加えると、コロイド粒子が集まり沈澱する。このようなコロイドを疎水コロイドという
- 少量の電解質を加えても沈澱しないコロイドに大量の電解質を加えると沈澱する。このようなコロイドを親水コロイドという
- コロイド溶液に電極を差し込み電圧を加えると、正に帯電しているコロイドは負極に向かって移動する
コロイドは正直出題する確率低いですが、念のため名称程度は覚えておくといいかもしれません。
同素体
同素体は同一元素からなるが、その原子の配列や結合が異なり性質も異なる。
- 硫黄(S)
- 炭素(C)
- 酸素(O)
- りん(P)
スコップ(SCOP)と覚えましょう。

金属の特性
比重が4あるいは5より小さいものを「軽金属」それより大きいものを「重金属」という
炎色反応についてはこちらを覚えましょう。
- リチウム…赤色
- ナトリウム…黄色
- カリウム…紫色
- カルシウム…オレンジ色
- バリウム…黄緑色
何故かナトリウムが良く出題されます。
熱伝導に関してはとりあえず公式だけでも頭に入れておきましょう。
Q=kST(t₁-t₂)/L
k=比例定数、S=断面積、T=時間、t₁=高温部の温度、t₂=低温部の温度、L=距離
気体の特性
ボイル、シャルルの法則は乙類で学ぶのでこちらでは割愛します。
- 温度が高く圧力が低い時に理想気体に近づく
- 混合気体の全圧は各気体の圧力の和に等しい
ここで一つ例題
・次に掲げる物質のうち、物質量(mol)が最も大きいものはどれか。なおメタノールの分子量は32、水の分子量は18とする。
①0℃、1.013×105Paで22.4ℓの酸素、②48gのメタノール、③36gの水、④0℃、1.013×105Paで22.4ℓの水素、⑤0℃、2.026×105Paで11.2ℓの窒素
この問題な一見難しそうに感じますが、実は結構簡単に解けます。
まず、①と④はそのまま22.4ℓなので1mol、⑤は圧力が2倍になって体積が1/2になってるので同じく1molになります。
②と③ですが、ご丁寧に分子量も提示されているのでそのまま計算します。
48gのメタノール=48÷32=1.5mol、36gの水=36÷18=2mol
よって最も大きいものは③の水となります。
解き方さえ分かればボーナス問題なのでこのような問題で落とさない事が大事です。
溶液の濃度
覚える公式が
- 質量パーセント濃度=溶質の質量÷溶液の質量×100
- モル濃度=溶質の物質量÷溶液の体積
- 質量モル濃度=溶質の物質量÷溶媒の質量
実際にこの公式を使用して解く問題なあまり出ませんが、この式自体問題で出る事があります。
飽和溶液と析出
ここでは直接問題を解きながら解説します。
・80℃におけるホウ酸の飽和水溶液100gを20℃まで冷却した時に析出するホウ酸の量として、正しいものはどれか。なお、20℃及び80℃の水100gに対するホウ酸の溶解度は、それぞれ5g、25gとする
①12g、②16g、③18g、④20g、⑤22g
この問題はどのようにして解くか理解して解くのが普通ですが、余計な事を考えずに求め方自体を覚えてしまいましょう。
問題文の飽和水溶液100g、溶解度5g、25gこの3つの数字だけ分かれば解けます。
ここで自分で考えたオリジナルの式ですが
x(問題ではホウ酸の量)÷飽和水溶液量=溶解度の差÷(飽和水溶液+溶解度の多い方)
この式に当てはめて求めてみましょう。
x÷100=20÷125
x=16
よって答えは②の16gとなります。

余計な事を考えなくていいのです。ただでさえ甲種は覚える事が多いので、この式だけ覚えてさっさと答えだけ求めていきましょう。
数字が変わっても求め方は同じです。
熱化学方程式
熱化学方程式の解き方も真面目に解くと全ての工程で熱化学方程式をまとめる必要があり時間が掛かるので、ちょっと簡単な方法で解いていきます。
いちいち理屈は解説しないので、解き方だけ覚えましょう。
・水素(H₂)、炭素(C)、プロパン(C₃H₈)の燃焼熱がそれぞれ286kJ/mol、394kJ/mol、2219kJ/molである場合、プロパンの生成熱として正しいものは次のうちどれか。
①107kJ/mol、②215kJ/mol、③1539kJ/mol、④2899kJ/mol、⑤4545kJ/mol
まず、最初の方で解説した酸素量を求める公式でプロパンの酸素量を求めます。
C₃H₈+5O→3CO₂+4H₂O
この式のCO2とH2Oの係数を問題文の燃焼熱と掛けます。
3×394+4×286=2326
そして、この数字からプロパンの燃焼熱を引きます。
2326-2219=107
よって答えは①の107kJ/molとなります。

余計な事は考えないのです。何故かこの解き方で解けるので、是非覚えておいて下さい。
水素イオン指数
えー、恐らくここが1番難しい(と思ってる)部分ですが、イオン指数の問題も出題率が高いのでしっかり理解しておく必要があります。
イオン指数の前にまずは「常用対数」について軽く解説します。
例えばこのような式ですが
log28
解き方ですが、この式の小さい数字を何乗したら大きい数字になるかを求めます。
なので、この式の場合2の3乗で8となるので答えは3となります。
危険物甲種ではこのlogの式では小さい数字が省略されています(実際は10が入ってます)
なのでlog2やlog3のように求めていきます。
あと最低限覚えるべき事として
- logA×B=logA+logB
- logA÷B=logA-logB
- logA^B=BlogA
例えばlog4とあればlog(2×2)=log2+log2とも表現出来ますし、log22=2log2とも表現出来ます。
状況に応じてこのように数字を変換する場合もあるので、このようなパターンは覚えましょう。

次に水素イオンについてですが[H+]が水素イオンで[OH-]が水酸化物イオンです。
この二つを掛けたものが水のイオン積と呼ばれこのようになります。
[H+][OH-]=1.0×10-14
この10-14の14がpHの値となります(重要)
ちなみにpHが7以下で酸性、7が中性、7以上がアルカリ性となります。
このpHは[H+]の常用対数をとり、-の符号をつけたものです。
pH=log1/[H+]=-log[H+]
あとは、電離度がありますが、求める水溶液に掛けて求めます(大抵電離度は1です)

ここまで良く分からなくても例題を解きながら解説していきます。
・0.06mol/ℓの水酸化ナトリウム水溶液の水素イオン指数(pH)について、次のうち最も値が近いものはどれか。ただし、水酸化ナトリウムの電離度は1とし、log2=0.30、log3=0.48とする。
①11.2、②11.8、③12.1、④12.2、⑤12.8
まず、水酸化ナトリウムは水酸化物イオンなので[OH-]です。
水酸化ナトリウム0.06mol/ℓは指数で表すと6×10-2となります。
ここで先程の水のイオン積の式に代入すると
[H+]×6×10-2=1.0×10-14
[H+]=1.0×10-14÷6×10-2=1/6×10-12=6-1×10-12
これを先程のpHの公式で求めていきます。
pH=-log[H+]=-log(6-1×10-12)=log6+12=log(2×3)+12=log2+log3+12
ここで問題文のlogの数値を当てはめると
0.30+0.48+12=12.78
このようになるので、答えは⑤の12.8となります。
良く分からないかもしれませんが、慣れてくると少しずつ意味が分かってきます(多分
もう一問解いてみましょう。
・pH=1.0の塩酸200mℓと0.02mol/ℓの水酸化ナトリウム水溶液800mℓとを混合した。この水溶液の水素イオン指数は次のうちどれか。なお、水酸化ナトリウムの電離度は1とし、log=0.30とする。
①1.4、②1.7、③2.4、④11.6、⑤12.6
まず、pH=1.0の場合、水素イオン濃度は0.1mol/ℓとなります。それが塩酸200mℓ(0.2ℓ)とあるので0.1×0.2=0.02molとなります。
次に水酸化ナトリウムは水酸化物イオンとなり、同じく計算すると0.02mol/ℓ×0.8ℓ=0.016molとなります。
この2つの水溶液を混合すると、中和され最終的に水素イオンが0.02-0.016=0.004mol残ります。水溶液の合計は1ℓとなるので(200mℓ+800mℓ)水素イオン濃度は0.004mol/ℓとなり、この値をpHの公式で求めます(0.004=4×10-3)
pH=-log[H+]=-log(4×10-3)=-log22+3=-2log2+3=-2×0.3+3=2.4
となるので答えは③の2.4となります。
実はこの問題は水素イオン濃度0.004mol/ℓが分かった時点で解く事が可能です。
0.004は0.001より大きく0.01より小さいので0.001=pH3、0.01=pH2となるので、0.004のpHは2より大きく3より小さい事が分かります。したがって答えは2.4となります。
この解き方は選択肢に似たような数字がある場合は使えませんが、今回の問題のように数字が離れている場合は早い段階で解く事が可能です。
ただでさえ問題数の多い甲種の試験では試験時間の短縮も大切なので、解き方の一つとして覚えておいて下さい。

酸・塩基・中和
酸は水に溶解すると電離して水素イオンを生じる物質、または他の物質に水素イオンを与える物質。
塩基は水に溶解すると電離して水酸化物イオンを生じる物質、または他の物質から水素イオンを受け取る事が出来る物質。
中和は酸と塩基の溶液を当量ずつ混ぜる時、中性となって塩と水の出来る反応をいいます。
中和滴定する場合、pH指示薬としてフェノールフタレインとメチルオレンジを使用して調べますが、組み合わせはこのようになります。
- 強酸+強塩基→どちらでも可
- 強酸+弱塩基→メチルオレンジ
- 弱酸+強塩基→フェノールフタレイン
- 弱酸+弱塩基→どちらでも可
強酸は硝酸、硫酸、塩酸。強塩基は水酸化ナトリウム、カルシウム、カリウムなどアルカリ金属系の物質が強塩基となります。
問題では酢酸、シュウ酸、炭酸ナトリウムなど出てきますがそれらは弱〇〇となります。
ここで例題
・硝酸126gを中和するのに、1袋25kg入りの炭酸ナトリウムの最低必要数として、次のうち正しいものはどれか。なお、原子量はH=1、C=12、N=14、O=16、 Na=23とする。
①3袋、②4袋、③5袋、④6袋、⑤9袋
この問題を解くには最低限硝酸と炭酸ナトリウム、硝酸ナトリウムの化学式を覚える必要がありますが、この程度は完璧に覚えておきましょう(絶望

化学反応式を書いて求めますが、いつもの酸素量を求める公式に近いです。
〇〇HNO₃(硝酸)+〇〇Na₂CO₃(炭酸ナトリウム)→〇〇NaNO₃(硝酸ナトリウム)+〇〇H₂O+〇〇CO₂
このようになります。あとは両辺の係数を揃えて
2HNO₃+Na₂CO₃→2NaNO₃+H₂O+CO₂
このようになります。
つまり2molの硝酸と1molの炭酸ナトリウムで中和させると2molの硝酸ナトリウムが生成されるという事になります。
硝酸と炭酸ナトリウムの1mol当たりの分子量を計算すると
- 1+14+16×3=63
- 23×2+12+16×3=106
このようになり、2molでは126となります。
問題文では126kgとあるので2kmolを中和するのに必要な炭素ナトリウムは1kmolの106kg必要となり、
106÷25=4.24
となるので、最低5袋必要です。つまり答えは③の5袋となります。
金属のイオン化列、腐食
イオン化傾向の大きい順で並べると
Li>K>Ca>Na>Mg>Al>Zn>Fe>Ni>Sn>Pb>H>Cu>Hg>Ag>Pt>Au
となります。
覚え方として有名なもので
貸そうかな、まぁあてにするな、ひどすぎる借金
貸(K)そうか(Ca)な(Na)ま(Ma)あ(Al)あ(Zn)て(Fe)に(Ni)す(Sn)るな(Pb)ひ(H)ど(Cu)す(Hg)ぎ(Ag)る借(Pt)金(Au)

何故かリチウムが忘れ去られてますが、この語呂合わせは絶対に覚えておきましょう。
イオン化傾向が大きいものを求める問題では重宝します。
例えば、配管が鉄の場合腐食を防ぐためにはイオン化傾向が大きいものと接続します。
そのため、Feより大きいものを選ぶ事が必要となりそれが答えになります。
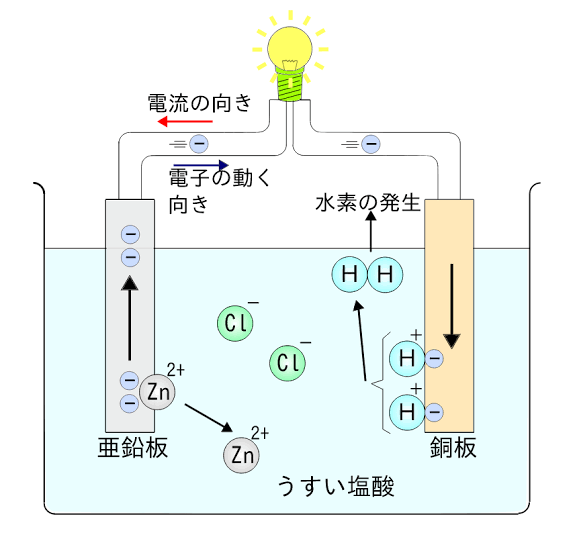
電池
電池に関してはこちらの画像をご覧下さい。
引用:ファイル|ボルタ電池
良く出題されるもので、ボルタ電池の仕組みについて問われる事があります。
そもそも電池は
- イオン化傾向の大きい金属板は酸化され陽イオンになり、電解液中に溶け出す。また、生じた電子は外部に流れ出しそのような電極を負極という
- イオン化の小さい金属板では、流れ込む電子によって還元反応が起こる。このような外部から電流が流れ込む電極を正極という
- 電子は正極方向に進み、電流は負極方向に進む
ボルタ電池は主に亜鉛から銅に電子が流れ、希硫酸中の水素イオンは銅板上で放電し水素を発生します。つまり、亜鉛側では酸化反応が起こり、銅板では還元反応が起きています。
たまに鉛蓄電池も出題されますが、鉛蓄電池は希硫酸の中に負極に鉛、正極に酸化鉛で接続する事で化学反応が起きて電圧が発生し電気を蓄えます。

あとは、実用電池の名称とそれぞれの起電力も過去に出題された事があるので一通り押さえておいた方がいいと思います。
- マンガン電池、アルカリマンガン電池…1.5V
- リチウム電池…3.0V
- 酸化銀電池…1.55V
- 鉛蓄電池…2.0V
- ニッケルカドミウム電池…1.3V
- ニッケル水素電池…1.35V
- リチウムイオン電池…4.0V
- ナトリウム硫黄電池…2.1V
酸化還元反応
一言で表すと物質が水素または電子を失う事を酸化といい、得る事を還元と言います。
つまり、酸化されて酸化数が減ったら還元された事になり(還元剤)酸化数が増えたら酸化された事になります(酸化剤)
とりあえず、化学反応式で左辺より右辺の酸化数が増えたら酸化剤、減ったら還元剤と覚えておきましょう。
酸化数の算出にはルールがあり
- 0以外の場合、必ず+か-を付ける
- 単体の原子の酸化数は0
- 単原子イオンの酸化数はそのイオンの電荷と等しくする(例えばCu2+の場合は酸化数+2、Cl-の場合は-1)
- 化合物中の水素原子の酸化数は+1、酸素原子の酸化数は-2(ただし過酸化水素だけは例外で酸素原子の酸化数は-1)
- 化合物中の原子の酸化数はその総和を0にする
あと個別に覚えておくと便利なものとして
- SO₄=-2
- CO₃=-2
- NO₃=-1
例えばこの変化について
・Fe+H₂SO₄→H₂+FeSO₄
この酸化数を調べるとまず左辺のFeは単体なので0、H2SO4のHは+1でSO₄は-2、右辺のH₂は単体なので0、FeSO₄のFeは+2、SO₄は-2となります。
この反応ではFeは0→+2になってるので酸化された事になり、Hは+1→0になってるので還元されています。
このように求めていきます。
触媒
触媒を加えると変化するものは
- 活性化エネルギー
- 反応速度
触媒を加えると活性化エネルギーが小さくなり反応速度が大きくなります。
化学平衡
さていよいよラストです。
化学平衡とは可逆反応の速さが均等なため、見た目上変化がない状態を指します。
覚える事として
- 温度を高くすると温度を低くする方向に平衡が移動する
- 圧力を大きくすると圧力を小さくする方向、すなわち気体の総分子量が減少する方向に進む
- 濃度が増加すると減少する方向に平衡が移動する
つまり、どちらかが大きくなったら左右均等にするために小さくなる方向へ平衡が移動すると覚えておきましょう。
コップに入れた水をイメージすると理解しやすいかもしれません。
ちなみに触媒を加えても平衡は移動しません。
まとめ
今回参考にしたテキストはこちらの2冊になります。
この2冊はこの「危険物甲種」を受験する人にとって必須のテキスト(と過去問)と言われています。
実際試験に行くと大多数の人がこの2冊を読んでいますし、似たような問題もかなり出題されるので、過去問はやっておくのがベストだと思います。
当ブログでの危険物に関する記事一覧はこちらになります。
この記事と合わせて法令と各類の記事全部で危険物甲種の内容を全て網羅しています。
内容がやや難しいですが、少しでも覚えやすく解説したつもりなので、受験される方は是非参考にしてみて下さい。
今回はこの辺で…










-160x90.png)



コメント
お世話になります。
危険物甲種試験の「物理・化学」について解説のところで
化学反応式
(次の問題で解きやすくなる公式も解説します)
その為、ここでとあるテキストに載っていた最強の求め方を解説します。
(2C+0.5H−O)÷2=必要酸素量
すごいありがたいです。百人力です。無敵です。
次の問題で
・次の有機化合物1molを空気中で完全燃焼させる時、必要な酸素の量が最も少ないのはどれか。
①エタノール、②ジエチルエーテル、③酢酸、④アセトアルデヒド、⑤メタノール
解
エタノール…C2H5OH=(2×2+0.5×6−1)÷2=3
ジエチルエーテル…C2H5OC2H5=(2×4+0.5×10−1)÷2=8.5
酢酸…CH3COOH=(2×2+0.5×4−2)÷2=2
アセトアルデヒド…CH3CHO=(2×2+0.5×4−1)÷2=2.5
メタノール…CH3OH=(2×1+0.5×4−1)÷2=1.5
となります。この中で1番酸素量が少ないのは⑤のエタノールと分かりました。
思うところが、
で、ジエチルエーテルのところが8.5では、ないのではなかろうか?
で、この中で1番酸素量が少ないのは⑤のエタノールと分かりました。
⑤のエタノールと分かりました。エ→メ メタノール
もう、この問題 答えだけ覚えたろと思って 答えは、⑤のエタノール
あ、エタノールかエタノールと覚えとったらええのかと思ったら
1.5のメタノールやないかと、思いとどまりました。
コメントありがとうございます。承認が遅くなり大変申し訳ありませんでした。
コメントで頂いた箇所は全て自分の計算&入力ミスでした。
ジエチルエーテルの酸素量は6で➄はメタノールで間違いありません。
ご指摘ありがとうございました。当該箇所は全て修正しましたのでご確認下さい。
お忙しい中、コメントを読んでくださってありがとうございます。
今度こそ、突破したいと思います。
無事、危険物甲種に合格することができました。
物化で一度落ちたので、物化の強化を試みてこのサイトにたどり着きましたが、大変分かりやすく、最終的には物化90点、代わりに一番安定していた法令で66点でしたが、結果オーライとなりました。
ありがとうございました。
コメントありがとうございます。また合格おめでとうございます!自分も物化がホント苦手で、他にも苦労している人が絶対いると感じ、こちらの記事を作成しました。少しでもお力になれたみたいなので幸いです。合格報告は非常に励みになります。こちらこそありがとうございました!
危険物甲種受験に伴い、様々なサイトを見ましたが、ほとんど知りたい情報がありませんでした(勉強時間の目安や難易度など掲載しているブログは沢山ありましたが、正直そんな情報はいりません)
kiki様のブログほど具体的な内容を解説しているサイトは他にはありませんので非常に重宝しています。多分この記事だけ読めば合格出来るんじゃないかと思うレベルの内容だと思っています。まだ受験まで時間がありますが、これからも活用させて頂きます。
コメントありがとうございます。厳密にはもっと覚える事がありますが、十分合格圏内にはなれるように記事を書いたつもりですので、是非参考にして下さい。合格を祈願します。
すごい参考になります!ノートにメモして勉強のお供にしています!ありがとうございます!
コメントありがとうございます!記事内の内容を全て把握すれば物理・化学に関しては合格ラインに届くと思います。不足している分はテキストなどで知識を身につけて下さい。合格結果お待ちしております^ ^